В. В. Ашапкин, к.б.н., с.н.с., НИИ физико-химической биологии им. А. Н. Белозерского, Московский государственный университет им. М. В. Ломоносова
Л. И. Кутуева, м.н.с., НИИ физико-химической биологии им. А. Н. Белозерского, Московский государственный университет им. М. В. Ломоносова
Е. Н. Волкова, д.м.н., профессор, Директор Научно-образовательного Департамента ООО Premierpharm
Б. Ф. Ванюшин, д.б.н., профессор, член-корр. РАН, заведующий отделом, НИИ физико-химической биологии им. А. Н. Белозерского, Московский государственный университет им. М. В. Ломоносова
Л. В. Берзегова – к.м.н., врач-косметолог, ведущий спикер компании Premierpharm, сертифицированный тренер компании Premierpharm
А. А. Григорьева – врач-косметолог, сертифицированный тренер компании Premierpharm
Список сокращений:
АПК – антиген-предъявляющие клетки, АФК – активная форма кислорода, ВКМ – внеклеточный матрикс, ДК – дендритные клетки, ЛС – лимфатический сосуд, ЛУ – лимфатический узел, МЖ – межуточная жидкость, ЭК – эндотелиальная клетка, ЛЭК – лимфатическая ЭК
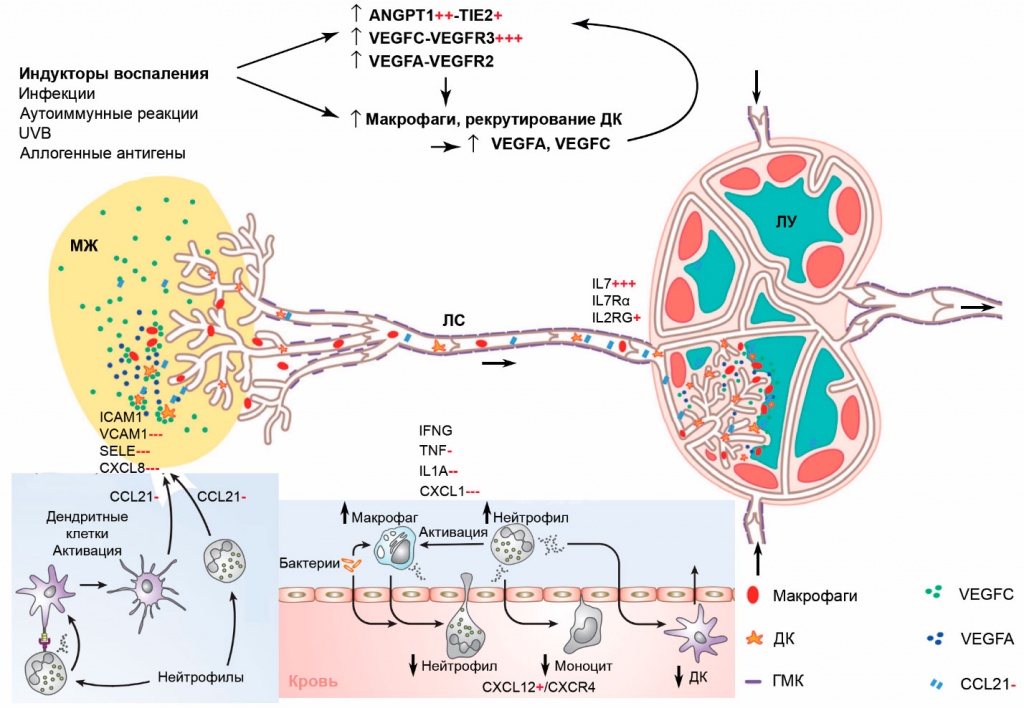
Гистологические исследования показывают, что непосредственные причины темных кругов и мешков под глазами весьма разнообразны [1, 2]. Мешки или темные круги под глазами, которые утром намного более выражены, чем накануне вечером, могут указывать на усиление локального кровотока и повышение проницаемости сосудов как результат воспалительного процесса. Воспаление представляет собой комплексную реакцию против потенциально вредных агентов, таких как микробы или поврежденные клетки (см. рис.). Эта комплексная реакция, включающая ответы сосудистой системы, миграцию и активацию лейкоцитов и системные ответы, в целом направлена на уничтожение или изоляцию потенциально вредного агента и запуск необходимых процессов заживления и восстановления поврежденной ткани [3]. Очевидно, что воспаление представляет собой защитную реакцию, тесно связанную с репарацией тканей. Тем не менее оно нередко бывает потенциально вредным и даже опасным. Как можно видеть по его типичным проявлениям (покраснение, боль, жар, опухание и др.), воспаление часто бывает чрезмерно активным и агрессивным процессом. Частью различных воспалительных реакций является лимфангиогенез. Лимфатическая система (ЛС) в целом самым непосредственным образом участвует в воспалительных реакциях и репаративных процессах. Одной из важнейших функций ЛС является транспорт лейкоцитов и растворимых антигенов от периферических тканей к лимфатическим узлам (ЛУ). Резидентные дендритные клетки (ДК) в соматических тканях захватывают антигены и мигрируют к ЛУ для их предъявления, но сами растворимые антигены достигают ЛУ быстрее, чем эти антиген-предъявляющие клетки (АПК). Предполагается, что таким способом ЛУ «инструктируются» для встречи соответствующих АПК. Вены служат главным местом выхода лейкоцитов из кровотока в окружающие ткани при воспалительных ответах на проникновение инфекционных агентов и повреждение тканей.
Особенности течения воспалительных ответов и скорость их разрешения в значительной степени определяются уровнем экспрессии генов, кодирующих хемокины и другие сигнальные молекулы воспаления в эндотелиальных клетках (ЭК) кровеносных и лимфатических сосудов. Мы исследовали эффекты препарата MesoEye™ C71 на уровне экспрессии таких генов.
В качестве объекта исследования использовали культивируемые эндотелиальные клетки HMVEC-D (human dermal microvascular endothelial cells), полученные из микрососудов кожи человека и представляющие собой смесь эндотелиальных клеток кровеносных и лимфатических сосудов (компания Lonza, CC-2543). После размораживания клетки культивировали на среде EGM-2 MV BulletKit (Lonza CC-3202) при температуре 37 оC в увлажненной атмосфере 5 % CO2 в пластиковых чашках Петри в течение двух пассажей. Для оценки влияния MesoEye™ C71 на клетки его добавляли к среде (10 мкл на 1 мл среды) перед началом третьего пассажа и выращивали клетки до формирования монослоя. Контрольные клетки выращивали аналогично, но без добавления препарата. По окончании третьего пассажа среду удаляли, а к клеткам добавляли реагент, стабилизирующий РНК, RNAprotect Cell Reagent (Qiagen, Германия). После открепления клеток от поверхности чашек Петри под действием реагента образующуюся суспензию переносили в стерильные пластиковые микропробирки и хранили несколько суток в холодильнике до выделения РНК.
Выделение и очистку суммарной РНК из клеток осуществляли с помощью набора RNeasy Mini Kit (Qiagen, Германия) по прописи, рекомендованной фирмой-производителем набора. Полученные образцы РНК использовали для синтеза первой цепи кДНК с помощью набора обратной транскрипции Maxima First Strand cDNA Synthesis Kit (Thermo Scientific, США) по рекомендованной производителем прописи. В качестве матрицы на каждую реакцию обратной транскрипции объемом 20 мкл использовали 200 нг очищенной суммарной РНК. Полученную реакционную смесь использовали непосредственно как матрицу для ПЦР из расчета 1 мкл смеси на реакцию объемом 25 мкл. Количественную ПЦР с флуоресцентно мечеными гибридизационными зондами (TaqMan qPCR) проводили с помощью набора qPCRmix-HS (Евроген, Россия) и термоциклера ДТ-322 (ДНК Технология, Россия). В качестве внутреннего стандарта использовали референсный ген GAPDH. Концентрацию его транскриптов измеряли в тех же самых ПЦР смесях, используя гибридизационный зонд, меченый другой флуоресцентной меткой: динамику амплификации кДНК для исследуемых генов измеряли по росту флуоресценции в канале Fam, а динамику амплификации кДНК для референсного гена – в канале Hex. Уровень экспрессии каждого гена измеряли в трех параллельных экспериментах на независимо полученных образцах клеток (биологические параллели). Для каждого образца проводили минимум три параллельные ПЦР в соседних лунках прибора (технические параллели). Полученные данные импортировали в программу Microsoft Excel 2003 и обрабатывали статистически, принимая концентрацию мРНК референсного гена во всех образцах за 1. Конструирование олигонуклеотидных праймеров и гибридизационных зондов для количественной ПЦР осуществляли с помощью онлайн-сервиса IDT PrimerQuest (https://eu.idtdna.com/PrimerQuest/Home/Index), а их синтез – в компании Синтол (Россия).
Локальное воспаление увеличивает проницаемость капилляров и венул, ускоряя потерю белка и жидкости в межуточное пространство даже при нормальном давлении. Продукция МЖ может при этом увеличиться в 10–20 раз, что превышает возможности лимфотока и вызывает выраженный отек. Агенты, увеличивающие проницаемость сосудов, и цитокины воспаления индуцируют внутриклеточные сигналы, приводящие к образованию просветов между ЭК, через которые клетки, макромолекулы и растворы могут преодолевать эндотелиальный барьер. В большинстве случаев изменения проницаемости быстро обратимы, хотя при хроническом воспалении они могут сохраняться довольно долго. Агенты, увеличивающие проницаемость эндотелия, действуют разными механизмами. Например, медиаторы воспаления гистамин, брадикинин и тромбин, которые приводят к быстрому и обратимому увеличению проницаемости, действуют иначе, чем цитокины интерлейкин 1 (IL1/IL-1) и фактор некроза опухолей (TNF), которые поддерживают повышенную проницаемость в течение нескольких суток. Проницаемость разных сосудов (вены, артерии, ЛС) также контролируется по-разному. Сложная сеть внутриклеточных посредников, таких как цАМФ, Ca2+, фосфо-инозитольные липиды, АФК и различные ГТФазы, участвует в этих эффектах. Ослабление межклеточных соединений в области адгезионных контактов связывают с фосфорилированием компонентов комплексов кадгерин-катенин. В большинстве случаев это фосфорилирование тирозиновых остатков в молекуле катенина бета 1, реже – плакоглобина. Гистамин, тромбин, TNF и васкулярный эндотелиальный фактор роста A (VEGFA) повышают фосфорилирование катенина бета 1, ассоциированного с кадгерином 5, что приводит к увеличению проницаемости монослоев ЭК в условиях культуры. При фосфорилировании цитоплазматического домена самого кадгерина 5 по остатку тирозина Y685 происходит ослабление его связи с катенином дельта 1, что сильно дестабилизирует контакты между ЭК [4]. Интересно, что такое фосфорилирование происходит главным образом в ЭК вен, где оно индуцируется умеренными гидродинамическими силами. По-видимому, это служит способом избирательно повысить чувствительность сосудов к агентам, увеличивающим их проницаемость. Например, брадикинин уже через 4 минуты после инъекции повышает проницаемость вен, но не артериол. В соответствующих участках образуются небольшие просветы в межклеточных соединениях. Фосфорилированные молекулы представляют собой лишь небольшую субпопуляцию кадгерина 5, и именно эта субпопуляция является специфической мишенью брадикинина. Аналогично брадикинину действует гистамин. Показано, что при действии брадикинина происходит убиквитинирование фосфорилированных молекул кадгерина 5, их интернализация и деградация. Описанная последовательность событий представляет собой механизм быстрого и обратимого открытия межклеточных соединений в венах при действии медиаторов воспаления, таких как брадикинин и гистамин.
Показано, что хемокин CXCL12 (он же – stromal cell-derived factor 1α/SDF1α) уменьшает проницаемость эндотелия кровеносных сосудов, индуцируемую тромбином [5]. Это стабилизирующее действие на эндотелий кровеносных сосудов опосредовано специфическим рецептором CXCL12 – CXCR4. Ген CXCL12 довольно активно экспрессируется в контрольных ЭК. При добавлении MesoEye™ C71 уровень его экспрессии возрастает в 1,8 раза, тогда как экспрессия гена CXCR4 не изменяется. В целом обнаруженный умеренный эффект препарата на активность сигнального пути CXCL12–CXCR4 должен приводить к некоторой стабилизации эндотелия кровеносных сосудов.
Рис. Компоненты воспалительной реакции и контролирующие их гены. В нижней части рисунка показаны резидентные и выходящие из кровеносных сосудов иммунные клетки, участвующие в локальных воспалительных ответах. Продукты генов IFNG, TNF, IL1A и CXCL1 повышают проницаемость сосудов и способствуют выходу лейкоцитов из кровеносных сосудов в очаг воспаления, продукт гена CXCL12 стабилизирует стенки сосудов и препятствует выходу лейкоцитов. Продукты генов ICAM1, VCAM1, SELE, CXCL8 и CCL21 обеспечивают проникновение активированных иммунных клеток в лимфатические капилляры и их транспорт к ЛУ. Сигнальные пути VEGFC-VEGFR3, VEGFA-VEGFR2, ANGPT1-TIE2 и IL7-ILTRα/IL2RG активируют дренажную функцию лимфатической системы.
Хотя вход жидкости в лимфатические капилляры происходит под действием гидростатического и осмотического давления, иммунные клетки автономно мигрируют к лимфатическим капиллярам через межуточное пространство, привлекаемые хемокинами, которые секретируются лимфатическими ЭК (ЛЭК). Главную роль в этом процессе играет хемокин CCL21 (CC chemokine ligand 21). Его положительно заряженный C-конец имеет высокое сродство ко многим протеогликанам и иммобилизует хемокин на волокнах внеклеточного матрикса (ВКМ), формируя градиент его концентрации. ДК, лейкоциты и макрофаги, экспрессирующие CCR7 (CC chemokine receptor 7) – специфический рецептор CCL21, детектируют этот градиент и мигрируют в направлении ЛС, инициируя воспалительные ответы [6]. Экспрессия гена CCL21 при добавлении MesoEye™ C71 уменьшается в 1,5 раза. Это свидетельствует об уменьшении локальных воспалительных реакций.
Проницаемость стенок кровеносных и лимфатических сосудов повышается под действием таких цитокинов воспаления, как интерлейкин 1α (IL1A), TNF и интерферон γ (IFNG), заметно уменьшающих уровень кадгерина 5 [7]. Проницаемость эндотелия ЛС сильнее всего (в 2,5 раза) повышается при действии интерферона γ, в то время как интерлейкин 1α и TNF на лимфатические сосуды действуют гораздо слабее, чем на кровеносные. VEGFC также незначительно изменяет проницаемость ЛС, а VEGFA вообще не влияет на нее. Возможно, такая низкая чувствительность ЛС является компенсаторным механизмом, предотвращающим фатальное нарушение барьерной функции лимфатического эндотелия в условиях постоянного присутствия высоких концентраций цитокинов и других медиаторов воспаления в области лимфатической системы. MesoEye™ C71 уменьшает уровень экспрессии генов TNF и IL1A в 1,5 и 3,8 раза соответственно и не влияет на уровень экспрессии гена IFNG. Еще одним медиатором воспалительных ответов является хемокин CXCL1. Кодирующий его ген весьма активно экспрессируется в ЭК микрососудов кожи, но при действии MesoEye™ C71 его экспрессия уменьшается в 8 раз. Следовательно, препарат заметно уменьшает выраженность локальных воспалительных реакций.
Известно, что при локальных воспалительных реакциях происходит быстрый выход нейтрофилов из кровеносных сосудов к очагу воспаления, где они играют роль «первой линии обороны» от повреждений ткани и инфекций. В последние годы было показано, что нагруженные захваченными чужеродными антигенами нейтрофилы не подвергаются апоптозу на месте, а быстро проникают в ЛС и транспортируются к ближайшим ЛУ, где, вероятно, участвуют в формировании адаптивных иммунных ответов [8]. Важную роль в этом процессе играют клеточные рецепторы селектин E (SELE), ICAM1 и VCAM1, а также хемокин CXCL8 (он же – IL8/IL-8). Ген CXCL8 очень активно экспрессируется в ЭК микрососудов кожи, но при добавлении MesoEye™ C71 уровень его экспрессии уменьшается в 8 раз. Гены SELE, ICAM1 и VCAM1 также довольно активно экспрессируются в ЭК. При добавлении MesoEye™ C71 уровень экспрессии ICAM1 практически не изменяется, а уровни экспрессии SELE и VCAM1 уменьшаются в 6,5 и 7 раз соответственно. Многие проангиогенные факторы, такие как VEGFA и CXCL8, увеличивают проницаемость сосудов [9]. В основе этих эффектов VEGFA и CXCL8 лежит стимуляция фосфорилирования и интернализации кадгерина 5. В обоих случаях фосфорилирование стимулируется малой ГТФазой RAC1. Действие CXCL8 на RAC1 опосредовано специфическим рецептором CXCR2. Как уже отмечалось, экспрессия гена самого CXCL8 под действием MesoEye™ C71 многократно уменьшается. Ген CXCR2 в контрольных клетках экспрессируется очень слабо, и добавление MesoEye™ C71 практически не влияет на его экспрессию. Ген RAC1, напротив, довольно сильно экспрессируется в контрольных клетках и в 1,5 раза слабее – в обработанных препаратом. В сумме эти эффекты MesoEye™ C71 должны ослаблять негативное влияние провоспалительного хемокина CXCL8 на сосудистую проницаемость.
При экспериментальной хирургической лимфедеме в коже хвоста мышей наблюдается повышение уровней экспрессии 429 генов и уменьшение уровней экспрессии 183 генов [10]. Среди первых экспрессия около 120 генов нормализуется добавлением VEGFC, что коррелирует с анатомическими признаками нормализации сети ЛС. Добавление экзогенного VEGFC благоприятно сказывается на всех физиологических аспектах воспалительного ответа: уменьшает объем отека, нормализует тканевую структуру, улучшает дренажную функцию ЛС, восстанавливает миграцию иммунных клеток. Экспрессия гена VEGFC находится на одинаково высоком уровне в контрольных и обработанных MesoEye™ C71 клетках. Однако экспрессия гена VEGFR3, кодирующего рецептор VEGFC, под действием препарата возрастает более чем в 6 раз. Следовательно, в целом активность сигнального пути VEGFC-VEGFR3 заметно увеличивается, а, значит, усиливается и дренажная активность лимфатической системы. Показано также, что подавление экспрессии VEGFR3 усиливает формирование воспалительного отека и аккумуляцию клеток воспаления и ингибирует лимфангиогенез в воспаленной коже [11]. И наоборот, активация лимфангиогенеза с помощью VEGFC супрессирует хронические воспалительные ответы в коже. Следовательно, увеличение активности сигнального пути VEGFC-VEGFR3 под действием MesoEye™ C71 способствует более эффективному разрешению хронических воспалительных состояний.
При экспериментальной лимфедеме в коже ушной раковины мышей, вызванной UVB-облучением, экспрессия ANGPT1 в виде трансгена подавляла внешние признаки отека [12]. У контрольных мышей облучение индуцировало активную инфильтрацию очага отека макрофагами, сильно увеличивало диапедез кровеносных сосудов и проницаемость ЛС. Экспрессия ANGPT1 заметно уменьшала все эти эффекты. Средняя толщина ЛС у контрольных мышей под действием облучения заметно увеличивалась, а у трансгенных мышей этот эффект был менее выражен, а средняя плотность лимфатических капилляров, наоборот, была выше, чем у контрольных. Облучение также приводило к потере клаудина 5, а экспрессия ANGPT1 в значительной степени предотвращала ее. Очевидно, увеличенная экспрессия ANGPT1 предохраняет ЛС от UVB-индуцированных повреждений. В культуре ЛЭК она индуцирует миграцию клеток и образование сосудистых структур, а также уменьшает проницаемость клеточного монослоя, индуцируя экспрессию гена клаудина 5 (CLDN5). Оба эффекта опосредованы рецептором TIE2 (он же – TEK receptor tyrosine kinase/TEK). Ингибирование экспрессии CLDN5 с помощью комплементарной siRNA, наоборот, увеличивает проницаемость монослоев ЛЭК. У гетерозиготных мышей с мутацией гена клаудина 5 (CLDN5+/-) уровень клаудина в коже заметно снижен, а чувствительность к индукции отека под действием UVB резко повышена [13]. При действии умеренной дозы UVB, не влияющей на кожу контрольных животных, у таких гетерозиготных мышей развивается выраженный отек, повышается проницаемость ЛС и увеличивается их размер. Вероятно, эффекты ANGPT1 связаны именно с индукцией экспрессии CLDN5. В отличие от VEGFC, ANGPT1 не влияет на пролиферативную активность ЛЭК: его защитное действие связано главным образом, если не исключительно, с сохранением целостности кровеносных и лимфатических сосудов. Экспрессия гена CLDN5 заметно (в 1,6 раза) возрастает при действии MesoEye™ C71. Экспрессия генов ANGPT1 и TIE2 также возрастает – в 4 и 1,7 раза соответственно. Все это свидетельствует о выраженном защитном действии препарата на эндотелий кровеносных и лимфатических сосудов в условиях, способствующих возникновению локальных воспалительных процессов.
Интерлейкин 7 (IL7/IL-7) является гомеостатическим цитокином, образующимся в стромальных клетках первичных и вторичных лимфоидных органов, а также в кератиноцитах, гепатоцитах и клетках кишечного эпителия [14]. Важными продуцентами IL7 являются ЭК лимфатических узлов. Сигналинг IL7 осуществляется через гетеродимерный рецептор, состоящий из α-цепи рецептора IL7 (IL7Rα/CD127) и общей γ-цепи цитокиновых рецепторов (IL2RG/CD132). IL7 необходим для развития T- и B-лимфоцитов и поддерживает их жизнеспособность и гомеостатическую пролиферацию. Он играет центральную роль в органогенезе ЛУ. В культуре ЛЭК экзогенный IL7 слабо влияет на пролиферацию, но заметно стимулирует адгезию к фибронектину, миграционную активность и транскрипцию гена PROX1. Он также заметно увеличивает способность культивируемых ЛЭК образовывать тубулярные структуры на коллагеновом матриксе. У гомозиготных по нуль-мутации гена IL7Rα (IL7Rα-/-) мышей дренажная активность ЛС заметно ухудшена, а у трансгенных мышей с повышенной экспрессией IL7 она, наоборот, повышена. Дренажная активность ЛС кожи у взрослых мышей дикого типа заметно усиливается при инъекциях в течение 7 дней рекомбинантного IL7. Это делает IL7 весьма перспективным кандидатом на роль противоотечного препарата. Уровень экспрессии гена IL7 в ЭК многократно (в ~17 раз!) возрастает при действии MesoEye™ C71. Экспрессия гена IL7Rα практически не изменяется под действием препарата, а гена IL2RG умеренно стимулируется (в 1,8 раза). В целом эти результаты указывают на заметное усиление дренажной активности ЛС при добавлении MesoEye™ C71.
MesoEye™ C71 препятствует увеличению проницаемости стенок кровеносных сосудов под действием цитокинов воспаления интерлейкина 1α (IL1A) и фактора некроза опухолей (TNF), а также хемокинов воспаления CXCL1, CXCL8 и CCL21, ингибируя экспрессию соответствующих генов, и стимулируя экспрессию гена хемокина CXCL12 (stromal cell–derived factor 1α/SDF1α), стабилизирующего эндотелий кровеносных сосудов. Он способствует более эффективному и быстрому разрешению хронических воспалительных состояний, стимулируя активность сигнальных путей VEGFC-VEGFR3, ANGPT1-TIE2 и IL7- IL7Rα- IL2RG, улучшающих дренажную функцию ЛС и препятствующих увеличению сосудистой проницаемости, диапедезу и возникновению локальных воспалительных отеков.


Комментарии