Старение лица – сложный многофакторный процесс, затрагивающий все структуры анатомии. Скелет, связки, мышцы, жировая ткань и кожа претерпевают возрастные изменения с разной скоростью, однако все структуры взаимосвязаны. Таким образом, изменения в одной структуре влияют на другие. Возрастные изменения всех мягких тканей лица начинаются в разное время и прогрессируют с разной скоростью. Все изменения в совокупности приводят к уменьшению поддержки мягких тканей, расположенных выше кости, которые затем поддаются воздействию силы тяжести. Потеря структурной поддержки из-за уменьшения объема и изменений в лицевых мышцах и их соединительнотканном каркасе приводит к смещению мягких тканей и их повышенной дряблости. Фасциальный каркас и дерма состоят из компонентов соединительной ткани, преимущественно из коллагена и эластина. Содержание эластина и коллагена снижается с возрастом, когда возникает дисбаланс в обмене белков, поскольку деградация коллагена ускоряется, в то время как его синтез уменьшается. Это отсутствие баланса (дисрегуляция) приводит к дальнейшему разрушению соединительной ткани.
Лицевые мышцы – тип поперечнополосатых мышц, обеспечивающих мимику и выполняющих функции жевания. В отличие от скелетных мышц, лицевые мышцы встроены в соединительнотканный каркас, который соединяет все ткани от костей до кожи. В частности, мышцы в области щеки взаимосвязаны с помощью срединно-лицевой поверхностной мышечно-апоневротической системы (SMAS). Ослабление мышц щек (особенно скуловой мышцы) может способствовать опущению мягких тканей средней трети лица, что приводит к увеличению выраженности носогубной складки, формированию брылей и потере контура линии подбородка.
Дисбаланс между деградацией и синтезом новых мышечных волокон приводит к функциональным сбоям, известным как саркопения. Ремоделирование мышц может помочь изменить контур лица за счет эффекта лифтинга, который в значительной степени улучшает общий вид. В целом, сочетание возрастных изменений лица приводит к изменению формы лица, которую невозможно улучшить, воздействуя только на один тип тканей. Следовательно, для устранения возрастных изменений лица необходимо применять более глубокие алгоритмы лечения. Они могут включать совместное воздействие на более глубокие фасциальные и мышечные слои, поскольку они способствуют изменению положения тканей лица.
В статье будет рассказано о технологии HIFES, которая синхронизированна с радиочастотным нагревом. Данное сочетанное воздействие реализовано в аппарате EMFace (BTL Industries Ltd), воздействующем на лицевые мышцы, их фасции и дермальный слой для омоложения лица. Результаты исследования показали, что процедура индуцирует плотную сеть коллагеновых и эластиновых волокон после обработки синхронизированными радиочастотами и HIFES.
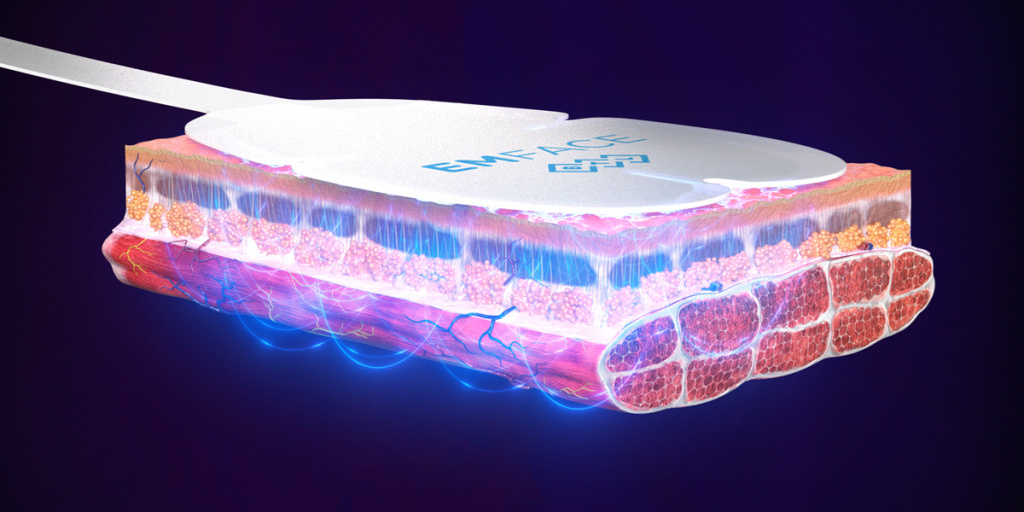
С помощью специальных аппликаторов, которые наклеиваются на лицо в проекции мышц-леваторов, создается сигнал, проходящий вдоль нейрона вплоть до нервно-мышечного соединения – места, где двигательный нейрон соединяется с мышцей. Эти сигналы преодолевают барьер нервно-мышечного соединения и передаются мышце, которая вынуждена сокращаться. Этот процесс обходит произвольное намерение мозга, вызывая принудительное сокращение с помощью электрической стимуляции. Стимулы HIFES повторяются с такой частотой, что лицевые мышцы не могут расслабляться в промежутках между отдельными импульсами. Поскольку мышца не может расслабиться при дополнительных раздражителях, она вынуждена сокращаться еще больше, что постоянно увеличивает силу сокращения с каждым дополнительным сигналом. Правильный выбор этих двух факторов (напряженность электрического поля и частота) приводит к так называемому супрамаксимальному сокращению, запускающему деление миоядер, что увеличивает плотность мышечного волокна1.
Исследования, проведенные на скелетных мышцах, показали, что белки теплового шока (HSP) и клетки-сателлиты (SCs) могут активироваться при интенсивных мышечных нагрузках в ответ на применяемые стимулы. Белки теплового шока – это класс функционально сходных белков, экспрессия которых возрастает при повышении температуры или при других стресс-воздействиях на клетку. Тепловым шоком является реакция клеток и систем на температуру, превышающую нормальные для организма показатели. Белки теплового шока являются основными молекулярными маркерами как непосредственно теплового шока, так и практически любого экзогенного стресса. Повышение экспрессии генов, кодирующих белки теплового шока, регулируются на этапе транскрипции и являются универсальными молекулярными шаперонами (от англ. Chaperon – сопровождать), т. е. белками, связывающимися с другими молекулами и в таком комплексе выполняющими определенные функции. Основной функцией HSP считается контроль образования новых белков и формирование их третичной структуры (фолдинг). Связываясь с растущими пептидными цепями на рибосоме, HSP предотвращают их неспецифическую агрегацию, предохраняют от преждевременного протеолитического распада и способствуют правильному и своевременному сворачиванию полипептида в третичную структуру. HSP также связывают измененные белки или белки, третичная структура которых уже сформировалась неправильно, защищая клетку от их воздействия.
Клетки-сателлиты – это стволовые клетки мышечного происхождения, ответственные за развитие и обновление миоволокон. В состоянии покоя SCs остаются неподвижными, готовыми к активации, и обеспечивают дифференцировку для создания новых миоядер к существующим мышечным волокнам или генерируют новые мышечные волокна. Совместная активация HSP и SCs может способствовать изменению структуры мышечных микропротеинов. В здоровой мышце это может привести к уплотнению мышечной ткани и общему улучшению качества мышц. В атрофированной мышце изменение структуры мышцы может привести к гипертрофической реакции, обращающей атрофию вспять. Однако не только мышца реагирует на сигнальные молекулы. Также было задокументировано, что фасциальный слой реконструирует себя в ответ на тепловые и механические раздражители.
HSP присутствуют в цитоплазме в комплексе со специальным транскрипционным фактором HSF (от англ. Heat shock factor – фактор теплового шока). При стрессорном воздействии HSF отделяется от HSP, приобретает ДНК-связывающую активность и накапливается в ядре, где активирует транскрипцию новых шаперонов и подавляет транскрипцию других генов.
Белки теплового шока принимают участие в транспортировке белковых молекул через мембраны митохондрий и ядерную оболочку в процессинге белков до антигенных пептидов и их связывании с молекулами главного комплекса гистосовместимости (Major histocompatibility complex – MHC) 1-го класса.
Взаимодействуя с микротрубочками и микрофиламентами, HSP стабилизирует цитоскелет, что увеличивает устойчивость клетки к механическому повреждению, денатурации и агрегации белков клетки.
Выделяют четыре основных семейства HSP:

Особый интерес представляют низкомолекулярные белки с массой 20–30 кДа. Функционально это белки-шапероны, играют роль в реализации апоптоза и реорганизации микрофиламентов, участвуют в сокращении мускулатуры. HSP также могут активироваться при нагревании в диапазоне 40 °C. Таким образом, вместе с мышечными сокращениями тепло может еще больше повысить уровень высвобождаемого HSP. Недавнее исследование, проведенное Кинни и его коллегами, измерило температуру лицевых мышц во время терапии HIFES и RF и показало, что температура в мышечной ткани достигала 40 °C1.
Кроме того, основной эффект синхронизированного радиочастотного нагрева тканей можно увидеть в фасциальном каркасе. Фасциальный каркас в основном состоит из коллагена и эластина, которые, как известно, чувствительны к нагреву. Следовательно, нагревание до адекватных температур может вызвать восстановление коллагена и эластина в фасциальном каркасе, что приводит к повышению его эластичности и плотности.
Миогенез скелетных мышц – это процесс образования мышечной ткани, управляемый множеством различных внутренних и внешних факторов. На ранних стадиях миогенеза моноядерные миогенные клетки делятся митотически, затем выходят из клеточного цикла, становясь миобластами, в последствии сливаясь в многоядерные миотрубки, которые дифференцируются во взрослые мышечные волокна.
Исследования, проведенные Sugiyama et al., показали, что в скелетных мышцах развиваются две системы шаперонов, которые работают независимо друг от друга в поддержании и дифференцировке мышц. Одна система включает в себя HSPB2 и HSPB3, а другая – HSPB5, HSPB1 и HSPB6. Экспрессия HSPB2 и HSPB3 наблюдалась во время мышечной дифференцировки под контролем MyoD, что позволяет предположить, что они представляют собой дополнительную систему, жестко регулируемую миогенной программой, тесно связанной с мышечной дифференцировкой. HSPB1 и HSPB5 образуют миотрубково-специфическую ассоциацию с актиновыми микрофиламентами, что подтверждает их цитопротекторную роль. Также стоит отметить, что в миобластах HSPB1 не наблюдалось, что позволяет предположить возможное участие этих sHSP в начальной организации сборки миофибрилл в миотрубках. В зрелых мышцах HSPB2 не показал аналогичной локализации на актиновых пучках, хотя он локализуется на Z-линии аналогично HSPB5. В скелетных мышцах взрослого человека HSPB5 экспрессировался в медленных и быстрых мышцах и локализовался в Z-полосах3.
Участие sHSP в миогенезе было исследовано на модельном организме – Danio rerio (рыбка данио) с использованием «нокдауна» HSPB1 с морфолино-антисмысловыми олигонуклеотидами в развивающихся эмбрионах рыбок данио. Первоначально считалось, что у рыбок данио истощение этого белка не влияет на морфологию и функционирование скелетной или сердечной мышц. Однако детальный анализ морфантов показал, что HSPB1 принимает участие в регуляции развития черепно-лицевых мышц. Его истощение влияет на оптимальный рост черепно-лицевых миоцитов, а не на определение или пролиферацию миогенных предшественников. Это наблюдение позволяет предположить, что рыбка данио-рерио HSPB1 может не участвовать в морфогенезе скелетной и сердечной мышц или в организации миофиламента, а ее физиологическая роль может быть скорее связана с защитой миоцитов от механического или окислительного стресса. Аналогичные результаты были получены и для мышиной модели, в которой подавление экспрессии HSPB1 также не вызывало изменений фенотипа. Это явление объясняется компенсаторным эффектом, который может быть вызван другими sHSP, экспрессируемыми в сердечной и скелетной мышцах, например, HSPB2, HSPB5 и HSPB8. Для проверки этого предположения были проведены эксперименты с двойным нокаутом. Например, у мышей с нокаутом Hspb5/Hspb2 Brady et al. наблюдались тяжелые аномалии мышечных клеток. Потеря функций HSPB5 и HSPB2 приводит к дегенерации некоторых скелетных мышц, особенно языка и камбаловидных мышц. Эти данные свидетельствуют о том, что sHSP могут быть специфическими миофибрилл-стабилизирующими белками4.
В скелетных мышцах можно обнаружить семь малых белков теплового шока: HSPB1, HSPB2, HSPB3, HSPB5, HSPB6, HSPB7 и HSPB8. Чтобы определить, защищают ли sHSP клетки скелетных мышц от окислительного стресса, Escobedo et al. использовали две модели: индуцированное дифференцировкой увеличение HSPB1 и гиперэкспрессия HSBP1 в стабильно трансфицированных миобластах. Авторы показали, что HSPB1 защищает клетки скелетных мышц от повреждений, вызванных активными формами кислорода (АФК), путем повышения уровня глутатиона (GSH). Было показано, что повышенный уровень HSPB1 связан с повышенным уровнем GSH и уменьшением опосредованного перекисью водорода повреждения клеток, а также окисления белка. Эти данные указывают на то, что HSPB1 защищает скелетные миобласты от окислительного стресса и может играть ключевую роль в регулировании системы GSH и резистентности к АФК в клетках скелетных мышц5.
Также исследовано участие sHSP в стабилизации саркомерных единиц у беспозвоночного (Drosophila melanogaster). Во время мышечного сокращения некоторые белки, такие как филамин, претерпевают обратимое раскрытие и повторное сворачивание. Эти периодические конформационные изменения делают его подверженным сбоям, что впоследствии может привести к образованию токсических агрегатов и нарушению миофибриллярной структуры. Для предотвращения неблагоприятного накопления подвергшийся стрессу белок соединяют с комплексом, образованным, в частности, кошапероном BAG3 (Starvin у D. melanogaster), шаперонами Hsc70 и HSPB8 (Dm-HSP67Bc у D. melanogaster) и HSPB6. Члены упомянутого выше комплекса (например, HSPB8) локализуются в Z-полосе мышечной ткани, что предполагает их участие в поддержании Z-диска5.

Данные исследования доказывают, что sHSP играют важную роль в качестве белков, защищающих цитоскелет при эксцентрических упражнениях (сокращение с активным удлинением мышц). Исследования группы Паульсена показали, что однократная стимуляция непривычных максимальных эксцентрических упражнений способствует острой транслокации HSPB1 и HSPB5 в миофибриллярные структуры во время физической нагрузки, с последующим повышением уровней мРНК и белка для HSPB1 и HSPB5. Интересно, что сокращения с активным мышечным удлинением приводят к потере белков Z-диска и мембранного каркаса и сопутствующей транслокации HSPB1 и HSPB5 в Z-диск. Удлинение индуцированной сокращением транслокации HSPB1 и HSPB5 ассоциировалось с фосфорилированием этих sHSP, что может способствовать их защитной активности. Это наблюдение подтверждает, что sHSP могут помочь стабилизировать клетки скелетных мышц и ограничить их цитоскелетное разрушение в мышечных клетках за счет восстановления структур, поврежденных во время физических упражнений, которые также могут генерировать АФК, которые могут неблагоприятно влиять на клеточные компоненты6.
Во время интенсивной физической активности происходит повреждение мышечных волокон вследствие и значительного повышения температуры. В связи с этим также постулируется участие некоторых sHSP в миогенезе и поддержании организации цитоскелета в условиях гипертермии. Например, было показано, что HSPB5 предотвращает тепловое развертывание и агрегацию миозина II, что позволяет поддерживать ферментативные свойства миозина и, таким образом, сократительную активность мышц6.
Заранее обработанные стекла изучались при увеличении 40× и 200× с использованием флуоресцентного микроскопа (Olympus IX51, Токио, Япония) с УВ лампой (Olympus u-RFL-T, Токио, Япония). Для получения изображений стекол с образцами использовалась камера Canon EOS 1100D (Токио, Япония) и стандартное программное обеспечение CellSens (Гаага, Нидерланды). Процедура предварительной обработки обеспечивала маркировку сателлитоцитов в красный цвет, мионуклеи – в синий цвет и клеточных мембран отдельных мышечных волокон – в зеленый цвет. Полученные изображения анализировались посредством программного обеспечения Cell Profiler, выполняющего расчет цветовых кластеров. Уровень сателлитоцитов на каждом стекле определялся как соотношение между маркированными сателлитоцитами и общим числом мышечных ядер. Разница между результатами микроскопического исследования, полученными в начале исследования, после терапии и во время контрольного исследования, были статистически обработаны с использованием двухфакторного дисперсионного анализа (ANOVA) с уровнем статистической значимости α = 0.057.
Гото и соавторы сравнили выработку белков теплового шока после теплового стресса, механического стресса и одновременного воздействия тепла и механической нагрузки8.
Одновременное применение двух типов энергий показало значительно более высокое увеличение экспрессии белков теплового шока по сравнению с только тепловым или механическим стрессом, что подтверждает синергетический эффект применения двух типов энергий для мышечной гипертрофии.
Современные методы омоложения лица часто включают в себя инвазивные хирургические процедуры подтяжки лица, инъекции на основе нейротоксинов и филлеров.
Несмотря на их эффективность, они могут быть сопряжены с рядом побочных эффектов и нежелательных явлений, такие как длительное восстановление, рубцевание. Также у этих методов ограниченная эффективность в отношении сократительных свойств мышцы. EMFace позволяет получить результат без нежелательных явлений. Ремоделирование лицевых мышц в значительной степени способствует лифтингу структур лица. Аппарат EMFace может быть рекомендован для неинвазивного воздействия в области лица для уменьшения выраженности морщин и получения лифтинг-эффекта. Процедура на аппарате EMFace неинвазивная, приятная и быстрая, что является важным конкурентноспособным преимуществом и трендом в современных реалиях.
Терапия с помощью аппарата EMFace, одновременно доставляющего RF и HIFES, привело к значительному улучшению таких показателей как улучшение общего вида лица, повышение тонуса кожи и ремоделирование миофасциального каркаса за счет повышения экспрессии белков теплового шока и активации сателлитных клеток.
Повышение тонуса мышц-леваторов обеспечивает лифтинг-эффект, элевацию кончика брови и уменьшение складки в области верхнего века.
На основе результата 3D-анализа и оценки FWES, процедура приводит к уменьшению выраженности морщин на лице (36,6 %) и улучшению качества кожи (25,2 %). Процедура на EMFace является эффективной, комфортной и без нежелательных явлений.


