Проблема формирования патологических рубцов остается актуальной и на сегодняшний день. После любой травмы этап заживления происходит с формированием рубцовой ткани, при это рубец может быть физиологическим и патологическим. Сформированные рубцы можно разделить на виды:

Обычно заживление, как правило, заканчивается формированием физиологического нормотрофического рубца, который характеризуется как не выступающее над поверхностью кожи образование, близко по цвету к окружающей коже, без признаков атрофии и не сопровождающееся патологическими клиническими проявлениями (зуд, стягивание, боль). Причины формирования патологических рубцов до сих пор до конца не изучены и вызывают много вопросов. Однако в ряде исследований указываются такие факторы, как длительное септическое состояние раны на фоне стресса, хронических заболеваний и воспаления, также указываются среди причин эндокринопатии и иммунодефицитные состояния. Заживление различных ран включает большое количество одновременно протекающих процессов. В заживлении условно выделяют четыре фазы:
I - фаза воспаления и эпителизации, которая проходит на 7–10-е сутки. В данный период начинает формироваться грануляционная ткань.
II - фаза образования «молодого» рубца. Этот период проходит с 10-го по 30-й день заживления, при этом рубцовая ткань еще незрелая.
III - фаза образования «зрелого» рубца, проходящая на 30–90-е сутки. В данный период в зоне формирования рубца резко уменьшается кровоснабжение, и рубец становится более плотным.
IV - фаза окончательной трансформации рубца. Данная фаза наступает через 4 месяца после травмы тканей.
Таким образом, заживление раны – это сложный процесс, в котором принимают участие клеточные элементы соединительной ткани и факторы, продуцируемые различными клетками сосудистого эндотелия в том числе. Когда гипертрофический патологический рубец уже сформирован, то патологическая ткань, как правило, подвергается удалению или деструкции.
Удаление или деструкция может осуществляться как хирургическим путем, так и консервативными методами, среди которых выделяют:
Наиболее оптимальными являются высокоинтенсивные аппаратные методы, поскольку с одной стороны подвергают патологическую ткань полной или частичной контролируемой деструкции, с другой – деструкция происходит в щадящем режиме, что снижает риски образования гипертрофического рубца повторно. Факторы, которые используют в аппаратных технологиях – это радиочастотные, ультразвуковые и лазерные.
Большой интерес в настоящее время представляют высокоинтенсивные игольчатые радиочастотные методы. При этом существуют методы с изолированными и неизолированными иглами. Если речь идет о деструкции рубца на полном протяжении как по плоскости, так и в вертикальном направлении, то технология игольчатого RF предпочтительнее с неизолированными иглами. Кроме того, есть технологии введения «горячих» игл, что при усилении деструкции делает саму процедуру менее болезненной и уменьшает фазу отека и воспаления, что при заживлении играет более положительную роль.
После проведения деструкции патологической ткани необходимы регуляторные механизмы для физиологичного заживления. Так, фаза воспаления и эпителизации, при которой наблюдается отек в тканях, является ведущей. При формировании патологического рубца происходит нарушение гемостаза и системных факторов, имеющих тенденцию к усилению воспаления. Очень важным является баланс между тромбогенными и антитромбогенными медиаторами, антикоагуляционным и прокоагуляционным гомеостазом, которые регулируются биологически активными соединениями. Именно сосудистый гомеостаз поддерживается путем регуляции различных процессов, отвечает за регуляцию местного воспаления, а также выполняет защитную функцию и регулирует хемотаксические и репаративные процессы в ответ на локальное повреждение. Для регуляции данных процессов предлагается метод Cellenis PRP-терапии.

Одним из преимуществ этого метода является доступность биоматериала, поскольку он получается из крови пациента, легкости проведения методики и ее эффективности в ускорении регенерации тканей. Обогащенная тромбоцитами плазма представляет собой аутологичный по происхождению концентрат плазмы, в котором содержится большее количество тромбоцитов в сравнении с их уровнем в общей крови. При введении собственной плазмы, обогащенной тромбоцитами, происходит стимуляция регенерации клеток. Все компоненты, входящие в состав плазмы (белковые факторы роста, фибрин, фибронектин, витронектин и др.), являются аутологичными, что исключает риск иммунных реакций.
Действуя на все звенья регенерации тканей, Cellenis® PRP-терапия обеспечивает усиление трофики, а также в значительной степени сокращает первую фазу в каскаде регенеративных процессов. Плазма, обогащенная тромбоцитами, имеет иммуномодулирующие и противоаллергические свойства, используется в целях восстановления функций стимуляции и регенерации клеток, способствует улучшению тканевого дыхания. При этом аутоплазма не оказывает токсического и тромбогенного действия. Содержащиеся в тромбоцитах факторы роста PDGF, TGF-1, EGF, VEGF способствуют пролиферации и неоангиогенезу, но не имеют канцерогенного действия и не приводят к гиперплазии.
При проведении Cellenis® PRP-терапии стимулируется процесс регенерации клеток. Все компоненты, входящие в состав плазмы (белковые факторы роста, фибрин, фибронектин, витронектин и др.), аутологичны по происхождению, что исключает риск иммунных реакций.
Регуляцию регенеративных процессов в тканях осуществляет группа белков, называемых трансформирующими факторами роста-бета (TGF-), которые высвобождаются из альфа-гранул тромбоцитов. Значительный терапевтический эффект плазмотерапии обусловлен повышением концентрации в тканях основных факторов роста: тромбоцитарного фактора роста (PDGF), сосудистого эндотелиального фактора роста (VEGF), а также фактора роста фибробластов (FGF). В процессах регенерации участвуют и другие факторы роста, высвобождающиеся в меньшем объеме: инсулиноподобный фактор роста (IGF), интерлейкины, эпидермальный фактор роста (EGF). Каждый из перечисленных факторов роста имеет очень важное значение, таргетно воздействуя на фибробласты, стимулируя рост новых сосудов и нервных окончаний в зоне введения, регулируя процессы фагоцитоза в тканях. Очень важным является переход из пассивного в активное состояние тромбоцита. В норме в кровотоке тромбоцит представляет из себя маленькую безъядерную клетку, в которой и находятся альфа-гранулы с факторами роста. Активация тромбоцита происходит в физиологическом состоянии только в момент травмы, при котором форма тромбоцита становится амебообразной, и через образовавшиеся канальцы «выходят» альфа-гранулы с факторами роста для заживления и регенерации. Для искусственной активации в современных методах используют либо аутоактиваторы, либо запатентованные химические активаторы. Деструкция с помощью RF-игольчатой терапии является пусковым механизмом активации тромбоцитов, поскольку является повреждающим фактором, и происходит выделение факторов роста.
Необходимо отметить роль моноцитов в Cellenis® PRP-терапии. Моноциты усиливают работу факторов роста при локальных повреждениях, поскольку обладают мощным фагоцитарным действием, оказывая протеазное влияние. При деструкции патологической ткани очень важным фактором является «система внутренней очистки» от продуктов распада и воспаления.
Метод Cellenis® PRP-терапии, таким образом, имеет ряд преимуществ, одно из которых – оптимальная концентрация тромбоцитов, выделяется максимальное количество жизнеспособных тромбоцитов (до 90 % от уровня цельной крови).
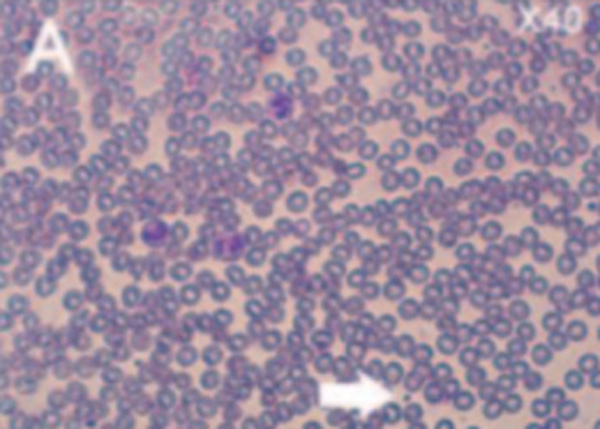
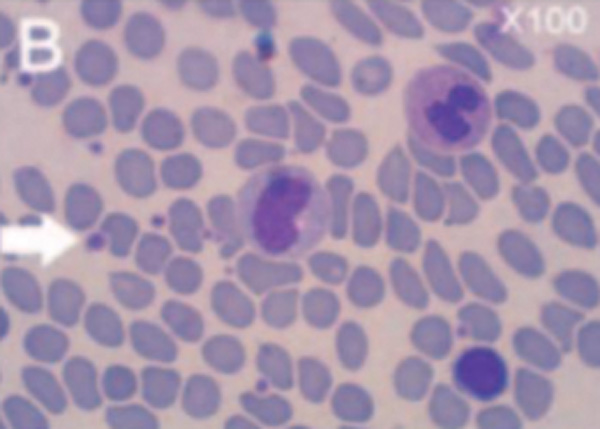
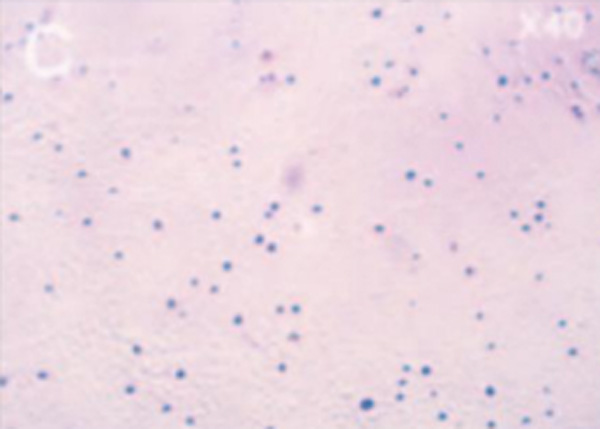
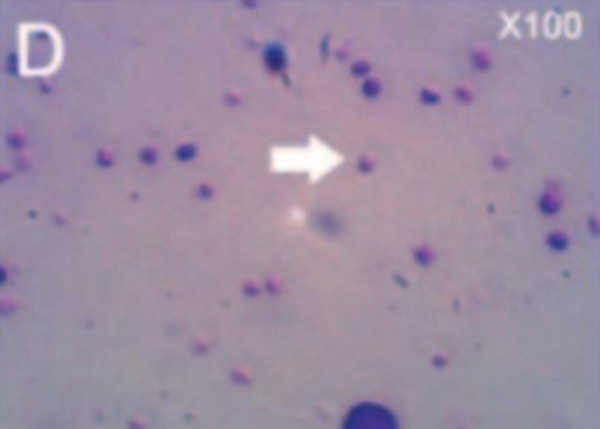
Окрашенная цельная кровь (A, B) и окрашенный Cellenis® PRP-препарат (C, D)
Важным преимуществом является наличие моноцитов, при этом сохраняется максимальное количество моноцитов и лимфоцитов: 86,2 % от общего количества мононуклеарных клеток, так, количество моноцитов превышает лимфоциты 2,7:1. В полученном препарате представлено лучшее соотношение анаболических клеток к катаболическим (22:1), что очень важно для репаративных процессов.
В Cellenis® PRP-технологии для сохранения жизнеспособности максимального количества тромбоцитов, предотвращения их преждевременной активации и уменьшения боли во время инъекции представлена улучшенная формула антикоагулянта MACD7 на основе ACD-A (цитрат натрия + декстроза) с добавлением буфера, который и обеспечивает физиологический pH 7,0 и оптимальное осмотическое давление.
Cellenis® PRP-технология представлена пробирками на 11 мл (6,5 мл PRP) и на 22 мл (13,0 мл PRP) с применением особого разделительного геля с калиброванной плотностью и специальным составом, который позволяет точно и надежно разделить фракции крови, оставив под гелем катаболические клетки (эритроциты, нейтрофилы и другие гранулоциты), а над разделительным гелем – слой с исключительно анаболическими клетками (моноциты, лимфоциты и максимально жизнеспособные тромбоциты). Разделительный гель позволяет удалить более 99,9 % эритроцитов, что соответствует практически полному их отсутствию в полученном препарате, и удалить более 90 % нейтрофилов и гранулоцитов, что позволяет в значительной доле снизить воспалительные реакции.
Безопасность и эффективность применения Cellenis® PRP подтверждена многолетними клиническими исследованиями и тестами: на отсроченную гиперчувствительность (GMPT), на цитотоксичность и острую системную токсичность.
Технология представлена в десятках стран мира под несколькими торговыми марками: Cellenis® PRP, Tropocells® PRP, MyCells® PRP, Eclipse® PRP. Данный продукт имеет все сертификаты качества: FDA (американский сертификат), CE Medical Devices (европейский сертификат) и регистрационное удостоверение на территории РФ (набор для получения обогащенной тромбоцитами плазмы PRP).
Количество клеток и факторов роста в Cellenis® PRP в 2 мл готового препарата
| Концентрация тромбоцитов | × 4–5 |
| Эритроциты (106 /0,01 мкг) | 0,0 |
| Лейкоциты (103 /0,01 мкг) | 0,2 |
| Гранулоциты, % | 8,5 |
| Моноциты, % | 86,2 |
| PDGF(пг/мл) | 2048 |
| VEGF(пг/мл) | 220 |
| EGF (пг/мл) | 269 |
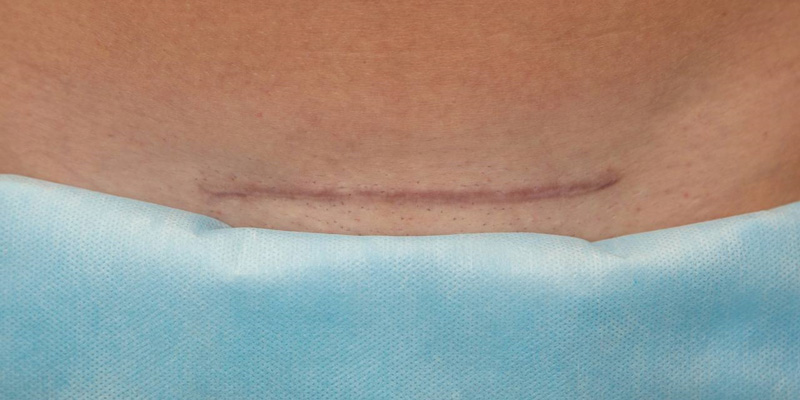
Пациентка Ю, 41 год. Гипертрофический рубец после кесарева сечения в 2020 году.
Аллергоанамнез не отягощен, соматический анамнез – без патологий.
Жалобы на чувство зуда, стягивание, рассматривает как значимый для себя эстетический дефект.
Лечение проводилось в виде деструкции рубца с целью ремодуляции с помощью RF-игольчатого аппарата HYBRIDENERGY системой ультратонких игл длиной 1 мм и шириной 150 мкм, частота 1 МГц и мощность 35 Вт с длительностью импульса 250 мсек.
Затем проводили в эту же сессию Cellenis® PRP-терапию с пробиркой 11 мл иглой 0,3Х13 мм подкожно под рубец болюсно по 0,2 мл с интервалом 1 см, по периферии всего рубца по 0,2 мл линейно-ретроградно и микроболюсно внутрь рубцовой ткани по 0,1 мл с интервалом 0,5 см.

Через 3 недели провели повторную деструкцию с Cellenis® PRP-терапией. Таким образом, было проведено две сессии терапии. Оценка результата проводилась через 4 недели после лечения. Чувство зуда и стягивание отсутствуют, эстетический дефект для пациентки является незначимым, степень удовлетворенности высокая.
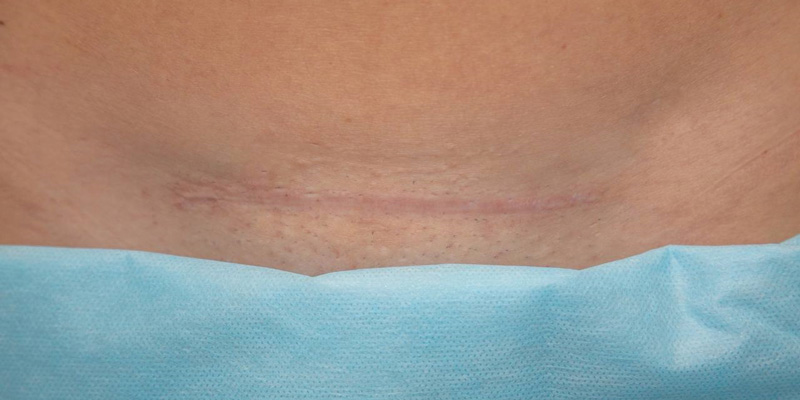
При лечении гипертрофических рубцов необходимо использовать деструктирующие методы с минимизацией агрессивных форм с последующим проведением Cellenis® PRP-терапии для физиологического восстановления тканей с формированием нормотрофических рубцов. Cellenis® PRP-технология является безопасной, высокоэффективной и незаменимой при регуляции этапов заживления.
Отмечу, что для себя я выбираю Cellenis® PRP, так как методика зарегистрирована в FDA, а значит, качество и безопасность продукта находятся на должном уровне. Важно также, что пробирка содержит цитрат натрия, который обрабатывает тромбоциты в режиме обратимых последствий. При этом Cellenis® PRP – не диагностическая пробирка, она разработана специально, чтобы мы могли вновь ввести полученную плазму с клетками в дерму.
И еще одно неоспоримое преимущество Cellenis® PRP – система закрыта, есть мембрана, которая отделяет форменные элементы от полученной плазмы с тромбоцитами. Закрытая система обеспечивает стерильность.
Могу сказать, что мой выбор основан на трех основополагающих фактах – эффективность, стерильность и безопасность, это и есть технология Cellenis® PRP.


