Старение – сложный биологический процесс, характеризующийся структурными, функциональными и обменными изменениями клеточных структур тканей. В отличие от внутренних органов, старение которых происходит достаточно скрытно, признаки этого процесса на коже всегда заметны.
Патоморфологически старение кожи характеризуется уменьшением ее толщины, снижением количества фибробластов, их размеров, скорости пролиферации, сглаживанием дермально-эпидермальной границы. Снижение синтетической активности клеток дермы приводит к уменьшению продукции ими таких важных компонентов основного вещества дермы, как коллагены, гликозаминогликаны, фибронектин и эластин1, 2.
В настоящее время существует ряд препаратов для коррекции возрастных изменений кожи на клеточном уровне. К используемым препаратам предъявляются строгие требования: они должны быть безопасны, не аллергенны, эффективны, рентабельны, удобны в применении. Этим высоким требованиям отвечает инъекционный препарат Meso-Wharton P199™, предназначенный для интенсивной «репарации» кожи. Ключевой компонент препарата – Wharton Jelly Peptide P199 (P199) – синтетический аналог эмбрионального пептида, именно этот пептид инициирует глубокие, стойкие антивозрастные и регенерационные эффекты в коже.
Для подтверждения anti-age эффективности Meso-Wharton P199™ могут быть использованы разные объекты исследования – культуры клеток: кератиноциты, эндотелиальные клетки, меланоциты и дермальные фибробласты человека3. Дермальные фибробласты представляют собой гетерогенную клеточную популяцию мезенхимного ряда и играют ключевую роль в регуляции процессов гомеостаза и восстановления кожного покрова. Они формируют оптимальные условия для пролиферации и функционирования других типов клеток (кератиноцитов, эндотелиальных, клеток волосяных фолликулов), регулируя клеточные взаимодействия4, 5. Фибробласты продуцируют проколлаген, фибронектин, проэластин, гликозаминогликаны и ламинин, участвуют в формировании базальной мембраны кожи, продуцируют и выделяют в межклеточное пространство цитокины и факторы роста6, 7. Также фибробласты играют важную роль в процессах эпителизации и заживления ран (8, 9). Поэтому они являются основной мишенью воздействия активных веществ, направленных как на омоложение кожи, так и на ее репарацию10, 11.
Известно, что при длительном культивировании фибробластов происходит репликативное старение культуры. Старение культуры фибробластов in vitro максимально близко отражает изменения, присущие старению кожи in vivo. Вместе с тем последние исследования показали, что при длительном культивировании в монослое клетки теряют не только способность синтезировать белки внеклеточного матрикса, но и возникает риск накопления в клетках хромосомных аберраций12. Кроме того, культивирование клеток в монослое не является естественным, изменяет характеристики клеток и не отражает реальные механизмы функционального состояния соматических клеток. При длительном культивировании в монослое клетки теряют одно из важнейших свойств своей функциональной активности – эпителио-мезенхимо-эпителиальную пластичность13, 14, 15. 3D-культура (сфероиды) по своим свойствам более полно повторяет нативную ткань по плотности клеток на единицу объема и представляет собой динамичную систему с организованным клеточным поведением – необходимым условием полноценного морфогенеза.
Цель нашего исследования заключалась в комплексном, многоплановом изучении влияния препарата Meso–Wharton P199™ как на 2D-, так и в 3D-культурах дермальных фибробластов человека.
Первичную культуру дермальных фибробластов получали из биоптатов кожи посредством механической дезагрегации и последующей ферментативной обработки. Для этого биоптат промывали фосфатно-солевым буфером, содержащим антибиотик (гентомицин) и обрабатывали раствором трипсина. Затем пипетировали, в результате чего освобождали клетки от матрикса, центрифугировали, отмывали от раствора трипсина и ресуспендировали в культуральной среде DMEM/F12, содержащей 10 % сыворотки. Высевали на чашки Петри в плотности 1 × 105 – 2 × 105 клеток/см2 и помещали в стандартные условия инкубирования (+ 37 0С, 5 % СО2). Культивировали до 4-го пассажа, охарактеризовывали по экспрессии характерных маркеров и криоконсервировали, создавая банк первичной культуры дермальных фибробластов человека, на которой проводили все дальнейшие исследования. Использование в исследовании одной и той же первичной культуры клеток позволяет сопоставлять и сравнивать полученные данные.
Для получения «стареющей» культуры клетки из полученного ранее банка размораживали методом быстрого оттаивания при +37 0С, отмывали от остатков сыворотки и ДМСО раствором Хенкса с помощью центрифугирования в течение 7 мин. при 1000 g. Супернатант удаляли, полученный осадок из клеток ресуспендировали в полной ростовой среде, высевали на чашки Петри и помещали в стандартные условия инкубирования (+ 37 0С, 5 % СО2). Культивировали до 18-го пассажа, когда становились хорошо заметны все признаки репликативного старения дермальных фибробластов. Размороженная, не пассированная культура клеток 4-го пассажа (Р4) считалась контрольной и соответствовала по своим характеристикам фибробластам молодой кожи.
Для исследования дозозависимости препарата Meso-Wharton P199™ на 2D-культуре аликвоты (500 мкл) пептида P199, растворенного в солевом буфере, смешивали с полной ростовой средой в соотношении 1:2, 1:10, 1:100, 1:1000. Анализ цитотоксичности проводили на 2D-культуре дермальных фибробластов 18-го пассажа (Р18). Клетки помещали на 12-луночные планшеты в плотности 10 000 клеток на лунку. В качестве контроля исследовали поведение клеток в полной ростовой среде без добавления пептида. Клетки культивировали в присутствии пептида в течение 72 ч., далее окрашивали растворами Hoechst 33258 (0,004 мг/мл) и йодида пропидия PI (0,001 мг/мл), с помощью которого оценивали жизнеспособность клеток по проникновению в их ядро PI под инвертированным флуоресцентным микроскопом Olympus CKX41 (Olympus, Япония).
Анализ биоактивности проводили на 2D-культуре дермальных фибробластов и помещали на покровные стекла в чашки Петри (35 мм). Исследовали морфологию клеток и экспрессию характерных для фибробластов маркеров: цитокератина 19, эластина, α-гладкомышечного актина (αSMA), PCNA (маркера пролиферации), коллагенов I, III и IV типов. В качестве контроля культивировали клетки 18-го пассажа в полной ростовой среде без добавления препарата. Для проведения иммуноцитохимического анализа клетки культивировали в присутствии пептида в течение 72 ч., далее фиксировали в 4 % растворе параформальдегида (4 0С, 20 мин.). Затем стекла инкубировали с первичными антителами к цитокератину 19, эластину, α-гладкомышечному актину (αSMA), PCNA (маркеру пролиферации), коллагенам I, III и IV. Результат визуализировали с помощью вторичных антител, конъюгированных с флуорохромами FITC (E=525 nm) и DyLight594 (E=617 nm). Ядра докрашивали раствором Hoechst 33258 (0,004 мг/мл). Анализ проводили с помощью лазерного сканирующего конфокального микроскопа Olympus Fluoview FV10 (Olympus, Япония).
Для изучения влияния препарата Meso-Wharton P199™ на образование сфероидов из дермальных фибробластов исследовали монослойные клеточные культуры фибробластов Р18, которые культивировали с добавлением в ростовую среду препарата Meso–Wharton P199™ и культуры фибробластов Р18, культивируемые без добавления препарата Meso-Wharton P199™. Для данного этапа исследования использовали аликвоты (500 мкл) пептида р199, растворенного в солевом буфере, и смешаные с полной ростовой средой в соотношении 1:10. Фибробласты культивировали в течение 72 ч., отмывали от ростовой среды раствором Версена, затем обрабатывали 0,25 % раствором трипсина и снимали с чашек. Подсчитывали количество клеток в суспензии и центрифугировали. Осадок ресуспендировали в полной ростовой среде и помещали на агарозные планшеты в концентрации 1 × 103 клеток в лунку. Агарозные планшеты помещали в 12-луночные культуральные планшеты и вели прижизненное наблюдение в стандартных условиях камеры прибора Cell-IQ (СМ Technologies, Финляндия) в течение семи дней. Фоторегистрацию осуществляли каждые 20 мин. с помощью программы Cell-IQ Imagen, обработку изображений проводили в программном пакете Cell-IQ Analyzer. Положительным контролем считали формирование сфероидов из фибробластов 4-го пассажа (Р4) в полной ростовой среде без добавления пептида.
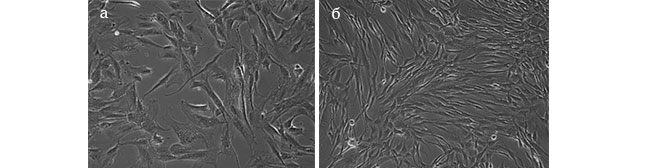
В культуре дермальных фибробластов 18-го пассажа, которые использовали для дальнейших исследований как стареющую, были хорошо заметны все признаки репликативного старения: спонтанное увеличение размера клеток, преобладание крупных плащевидных и парусовидных клеток (Рис. 1а). Темпы клеточного деления резко снижались. Контрольная культура (Р4) соответствовала по своим характеристикам фибробластам молодой кожи. В ней преобладали небольшие веретеновидные клетки, которые хорошо пролифелировали (Рис. 1б).
Рис. 1. Культуры дермальных фибробластов, используемые для дальнейшего исследования.
а – опытная культура фибробластов (Р18) – соответствует зрелой (стареющей) кожи;
б – контрольная культура фибробластов (Р4) – соответствует молодой коже
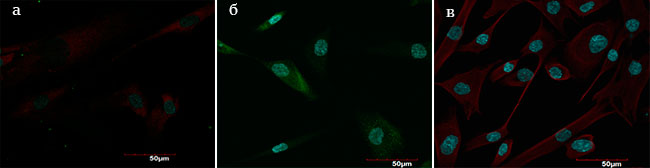
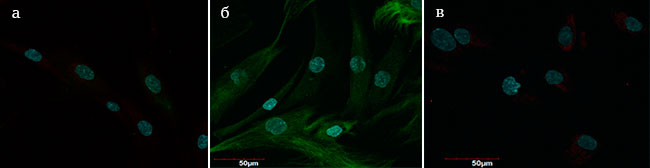
По экспрессии характерных для фибробластов маркеров культура 18-го пассажа (Р18) также соответствовала возрастным изменениям, наблюдаемым в коже in vivo. Контрольные клетки активно экспрессировали характерные для фибробластов маркеры (цитокератина 19, эластина, коллагенов I, III и IV типов), отвечающие за основные биомеханические свойства кожи, такие как гладкость, упругость, эластичность (Рис. 2а, б, в), а в опытной культуре (Р18) экспрессия маркеров заметно снижалась по сравнению с контрольной культурой (Рис. 3а, б, в).
Рис. 2. Контрольная культура фибробластов (Р4)
а – экспрессия маркеров цитокератина-19, эластина;
б – экспрессия маркеров коллагена III типа;
в – экспрессия маркеров коллагена I типа
Рис. 3. Опытная культура фибробластов (Р18)
а – экспрессия маркеров цитокератина-19, эластина;
б – экспрессия маркеров коллагена III типа;
в – экспрессия маркеров коллагена I типа
Результаты исследования дозозависимости препарата Meso-Wharton P199™ на 2D-культуре показали, что предлагаемые разведения 1:10, 1:100 и 1:1000 не оказывали цитотоксического действия на культуру дермальных фибробластов человека. Учитывая отсутствие морфологических и цитотоксических различий эффекта препарата при разведениях, для исследования биоактивности препарата Meso-Wharton P199™ использовали разведение: 1:10.
Эластин, объем которого составляет всего 2 % от общего объема белков дермы, наряду с коллагеновыми волокнами придает ей упругость и эластичность. К 50-летнему возрасту в большинстве эластических волокон наблюдаются дегенеративные изменения за счет снижения синтеза эластина фибробластами. Поэтому экспрессия фибробластами эластина является одним из основных маркеров старения кожи.
Коллаген – фибриллярный секреторный белок, наиболее распространенный в организме человека. Он образует волокна, переплетающиеся как нити в ткани. Коллаген и эластин формируют волокнистый каркас, в который могут врастать новые клетки, и обеспечивают коже упругость и эластичность, а нарушение их синтеза приводит к потере этих свойств. По морфологии коллаген принято делить на три группы: фибриллярный коллаген: коллагены I, II, III, V типов; сетевидный коллаген – коллаген IV типа, образующий опорную сеть базальных мембран; нитевидный коллаген – коллаген VI типа.
В дерме взрослого человека интерстициальный фибриллярный коллаген (I и III типы) является самой большой фракцией коллагена и составляет 70 % от сухой массы дермы. При этом содержание коллагена I типа составляет 80 %, а III типа – приблизительно 15 % от всего объема коллагена. На протяжении всей жизни человека содержание коллагенов уменьшается примерно на 1 % в год.
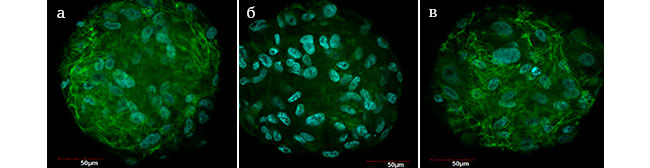
Иммуноцитохимическое окрашивание на характерные для фибробластов маркеры в нашем исследовании показало, что экспрессия цитокератина-19 и эластина в культуре дермальных фибробластов человека Р18, отвечающих за упругость и эластичность кожи, увеличивается после сокультивирования с препаратом Meso-Wharton P199™, по сравнению с контрольной группой (Рис. 4а, б, в).
Рис. 4. Экспрессия цитокератина-19 и эластина в фибробластах (Р18) после сокультивирования с Meso-Wharton P199™ (Ядра клеток докрашены Hoechst 33258 (синий))
а – увеличение × 10; б - увеличение × 40;
б – увеличение × 40;
в – увеличение × 10
Монослойные клеточные культуры являются признанной модельной системой, используемой в разработке и исследованиях лекарственных средств. Однако такая 2D-клеточная модель отличается от естественных условий. Обычная адгезивная культура представляет собой растущие двумерным (2D) монослоем клетки на плоской поверхности. Клетки, прикрепленные к искусственной пластиковой или стеклянной подложке, контактируют с другими клетками с образованием межклеточных контактов только в одной плоскости, что препятствует формированию многомерной структуры. Все органы и ткани, включая кожу, имеют трехмерную клеточную организацию, в которой клетки взаимодействуют друг с другом, образуя сложные комплексы контактов с другими клетками и внеклеточным матриксом, формируя таким образом уникальное микроокружение. Поэтому «старение» монослойной культуры фибробластов in vitro во многом сходно, но неполностью эквивалентно старению кожи in vivo. Воспроизвести все возрастные изменения на монослойной культуре в полном объеме не удается. Это приводит исследователей к переводу модельных систем из 2D- в 3D-условия культивирования. Одним из вариантов 3D-клеточных культур являются сфероиды. Они представляют собой трехмерные самоорганизующиеся в силу природных адгезивных свойств сферические кластеры клеток. При формировании сфероидов клетки могут восстановить межклеточные контакты и создать микроокружение, поддерживающее их нативный фенотип. Однако не все клетки могут образовывать сфероиды. Низкодифференцированные клетки человека, включая «незрелые» фибробласты, в условиях отсутствия адгезии способны агрегировать друг с другом, формируя новую многоклеточную структуру – сфероид, содержащий эпителиальный и мезенхимный компоненты. Стареющие культуры фибробластов способность к сфероидообразованию утрачивают. Для сфероидообразования важен определенный уровень экспрессии фибронектина и интегринов α5 и β1 фибробластами. Дифференцировка и последующее старение клеток сопровождаются утратой способности к мезенхимо-эпителиальному переходу, без которого невозможно формирование сфероидов. Таким образом, сфероидообразование является уникальной простой количественной тестовой системой для определения клеточной зрелости и оценки влияния на нее исследуемых препаратов.
Кроме того, 3D-клеточные культуры более стабильны, чем 2D-клеточные культуры. Их можно поддерживать в культуре в течение длительного времени – более 3 месяцев, в отличие от монослойных культур, которые быстро достигают конфлуентного состояния и требуют постоянного пересева или при отсутствии пролиферации («старые» культуры) погибают. Поэтому именно 3D-культуры стали активно использовать при изучении отсроченных эффектов лекарственных препаратов.
На рис. 5 представлена сборка отдельных фотографий на сроках: 12 часов, 24 часа, 3, 5 и 7 суток. Видно, что при сокультивировании культуры фибробластов Р18 с препаратом Meso–Wharton P199™, смешанного с ростовой средой, уже через 12 часов наблюдается образование рыхлого сфероида. В течение последующих дней происходит компактизация клеток и уплотнение сфероида, которое заканчивается к 7 суткам культивирования. В отличие от сфероидов, образованных из фибробластов Р4, размеры образованных сфероидов из фибробластов Р18 через 7 суток немного больше, даже после компактизации. Вероятно, это связано с большим размером клеток в культуре фибробластов Р18. Из культуры фибробластов Р18, культивированных без пептида, через 12 часов образуется рыхлый агрегат, который при дальнейшем культивироании не компактизуется, а остается рыхлым с темной некротической зоной внутри сфероида и рыхлым наружным слоем, состоящим из дебриса. Возможно, клетки не могут синтезировать достаточное количество внеклеточного матрикса для образования межклеточных контактов и последующего образования сфероида.
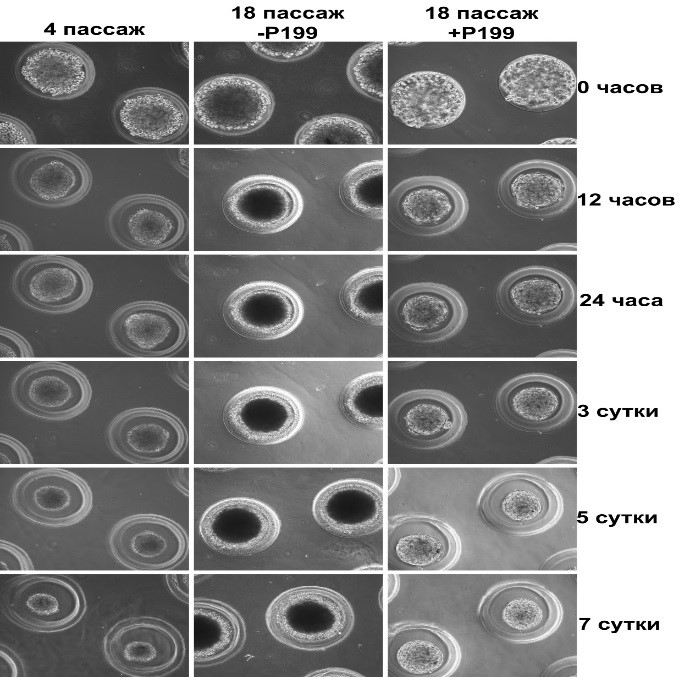
Рис. 5. Влияние препарата Meso–Wharton P199™ на образование сфероидов из дермальных фибробластов в условиях 3D-культивирования. Световая фазово-контрастная прижизненная цейтраферная микроскопия
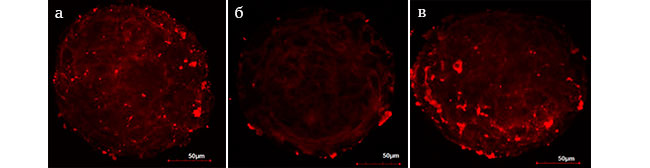
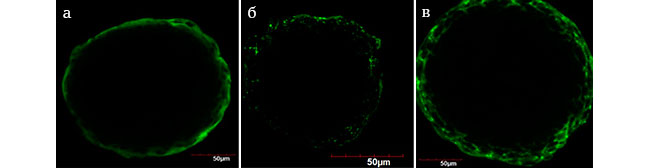
Исследование способности образовывать сфероиды показало, что присутствие в ростовой среде препарата Meso-Wharton P199™ стимулирует «омоложение» клеток и последующее восстановление мезенхимо-эпителиальной пластичности культивированных фибробластов за счет восстановленной способности синтезировать в достаточном для установления межклеточных контактов количестве компонентов внеклеточного матрикса (фибронектина и коллагенов), что влияет на способность формировать сфероиды. Результаты иммуноцитохимического исследования сформированных сфероидов, представленные далее, подтвердили наше предположение по восстановлению экспрессии компонентов внеклеточного матрикса. Было показано, что в сфероидах, культивированных в ростовой среде с добавлением препарата, практически все клетки экспрессировали эластин (Рис. 6а, б, в), а поверхностные клетки активно экспрессировали цитокератин-19 –белки внеклеточного матрикса, поддерживающие упругость кожи (Рис. 7а, б, в).
Рис. 6. Экспрессия эластина
а – сфероид из фибробластов Р18 после сокультивирования с препаратом Meso–Wharton P199™;
б – сфероид из фибробластов Р18 без препарата Meso–Wharton P199™;
в – сфероид из фибробластов Р4 (контроль)
Рис. 7. Экспрессия цитокератина-19
а – сфероид из фибробластов Р18 после сокультивирования с препаратом Meso–Wharton P199™;
б – сфероид из фибробластов Р18 без препарата Meso–Wharton P199™;
в – сфероид из фибробластов Р4 (контроль)
Препарат не оказывал ключевого влияния на экспрессию коллагенов I и III типов. Практически все клетки сфероидов экспрессировали эти коллагены. Однако при исследовании влияния на экспрессию коллагена IV типа было обнаружено, что после сокультивирования с препаратом р199 практически все клетки в сфероиде экспрессировали этот коллаген. Очевидно, анализируемый препарат активно стимулирует в фибробластах выработку коллагена IV – основного компонента базальной мембраны эпидермиса, дефицит которого приводит к старению кожи и развитию в ней патологических процессов (Рис. 8а, б, в). Также было установлено, что препарат 199 положительно влияет на уровень экспрессии фибронектина (Рис. 9а, б, в), который вместе с гликозаминогликанами составляют аморфный (основной) компонент межклеточного матрикса. Кроме того, фибронектин отвечает за адгезию, подвижность, дифференцировку и взаимную ориентацию клеток (6).
Рис. 8. Экспрессия коллагена IV типа
а – сфероид из фибробластов Р18 после сокультивирования с препаратом Meso–Wharton P199™;
б – сфероид из фибробластов Р18 без препарата Meso-Wharton P199™;
в – сфероид из фибробластов Р4
Рис. 9. Экспрессия фибронектина
а – сфероид из фибробластов Р18 после сокультивирования с препаратом Meso-Wharton P199™;
б – сфероид из фибробластов Р18 без препарата Meso–Wharton P199™;
в – сфероид из фибробластов Р4
Результаты данного исследования убедительно продемонстрировали эффективность применения препарата Meso-Wharton P199™ для омоложения кожи.